Der Brennwert von Lebensmittel steht auf jeder Verpackung und wir in kcal (Kilokalorie) bzw. kJ (Kilojoule) angegeben. Diesbezüglich drücken sich viele Menschen aber falsch aus und verwenden nicht den Einheitenpräfix kilo, sondern nur Kalorie. So habe ihr Joghurt zum Beispiel 180 Kalorien, was natürlich ein Blödsinn ist, denn der richtige Wert ist 1000-mal größer!
Da Kalorie und Joule in einem Atemzug genannt werden, müssen sie Einheit der gleichen physikalischen Größe sein und zwar der Energie. Wie hängen sie aber zusammen? Die Einheit Kalorie kommt aus der Wärmelehre und zwar entspricht 1 cal genau der notwendigen Wärme Q, um 1 g Wasser um 1 °C zu erwärmen.

Die Formel für die Erwärmung eines Körpers/Flüssigkeit lautet:

Dabei entspricht Q der zu- oder abgeführten Wärme, c ist die sog. spezifische Wärmekapazität des jeweiligen Körpers, m dessen Masse und ΔT die erzielte Temperaturänderung. Was kann man sich unter c vorstellen? Nun Q = c für m = 1 kg und ΔT = 1 °C. In Worten: Die spezifische Wärmekapazität c eines Körpers ist die notwendige Wärme Q, um 1 kg des Körpers um 1 °C zu erwärmen. Wasser hat eine spezifische Wärmekapazität von c = 4155 J/kg · °C, was ein sehr hoher Wert ist.
Hier habe ich die spezifische Wärmekapazität von Wasser experimentell bestimmt: https://stoppi-homemade-physics.de/spezifische-waermekapazitaet/
Wir wissen also: Um 1 kg Wasser um 1 °C zu erwärmen, werden 4155 J benötigt. Daher braucht man für 1 g Wasser nur noch 4.155 J, was dann genau 1 Kalorie entsprechen sollte (siehe oben). Es gilt also der Zusammenhang: 1 cal = 4.155 J.
Besitzt also ein Lebensmittel z.B. einen Brennwert von 200 kcal/100g, so entspricht dies 200 · 4.155 = 831 kJ/100g. Was kann man sich aber unter dem Brennwert eines Lebensmittel nun vorstellen? Es ist genau jene Wärme/Energie pro Gramm, welche bei vollständiger Verbrennung freigesetzt wird.
Genau diesen Brennwert möchte ich in einem Experiment durch den Bau eines Kalorimeters bestimmen. Der Aufbau sieht wiefolgt aus:
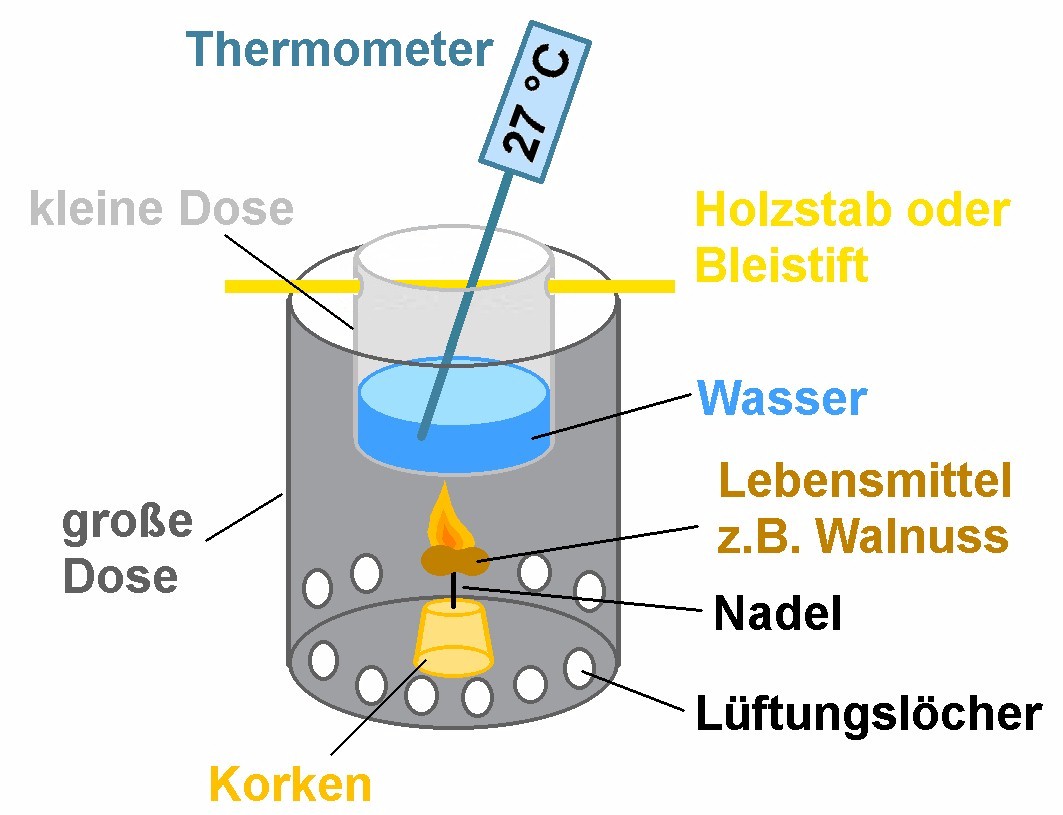
Das Lebensmittel, z.B. die Nuss wird entzündet und deren Flamme erhitzt das in der kleinen Dose befindliche Wasser. Die für dessen Erwärmung notwendige Wärme Q kennen wir aber durch die oben beschriebene Formel Q = c · m · ΔT mit c = 4155 J/kg·°C bzw. 1 cal/g·°C für Wasser. Damit die Flamme nicht rußt, befinden sich unten in der großen Dose viele Löcher.
Die Flamme des Lebensmittel erhitzt aber natürlich nicht nur das Wasser, sondern die kleine Dose selbst und auch die Luft. Damit aber möglichst viel Wärme für die Erhitzung des Wassers genutzt wird, soll zwischen kleiner und großer Dose nur ein kleiner Luftspalt von ca. 5–10 mm Breite vorhanden sein. Aber selbst dadurch wird man Wärmeverluste haben die dazu führen, dass nur ein gewisser Prozentsatz (z.B. 70%) der freiwerdenden Wärme in die Erwärmung des Wassers fließt. Aufgrunddessen wird der Brennwert des Lebensmittel IMMER zu niedrig bestimmt!
Hier zwei Tabellen mit Brennwerten:
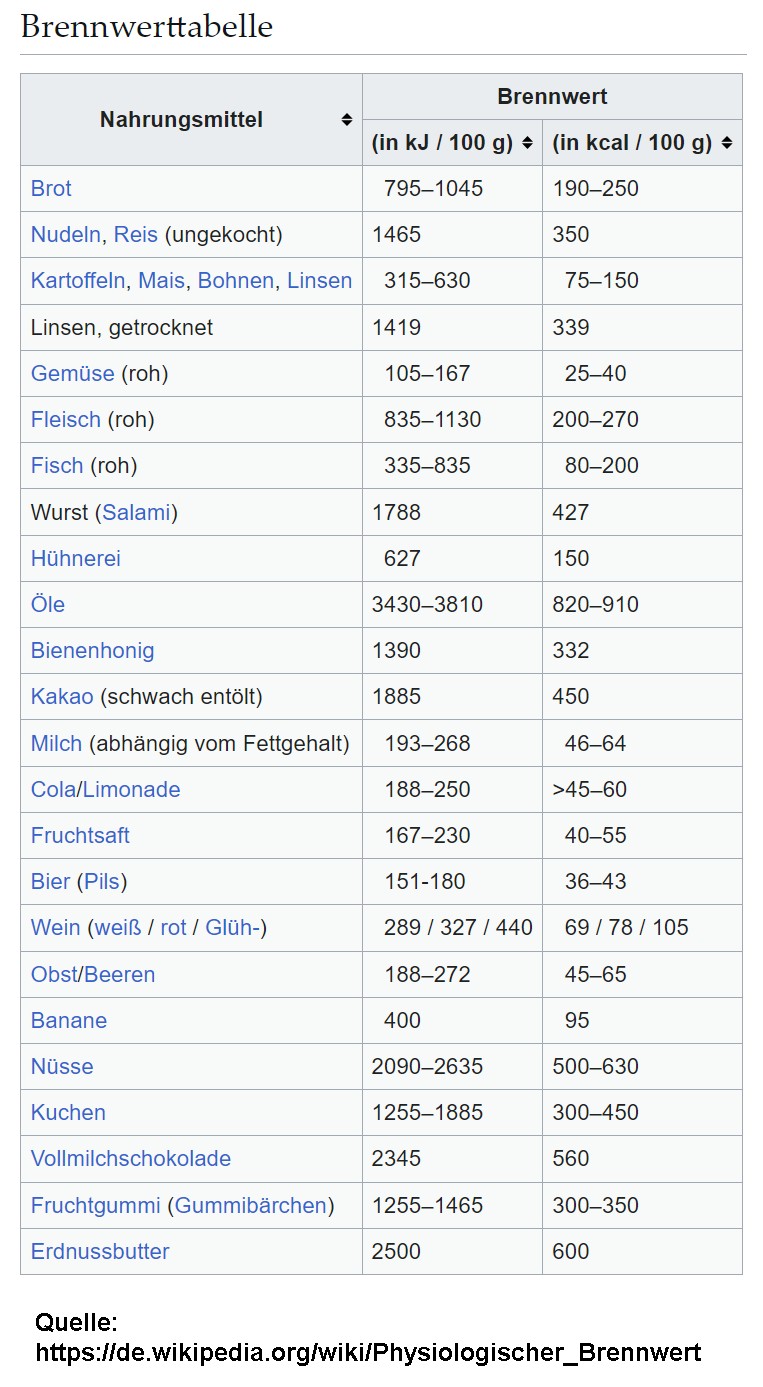
Quelle: https://de.wikipedia.org/wiki/Physiologischer_Brennwert
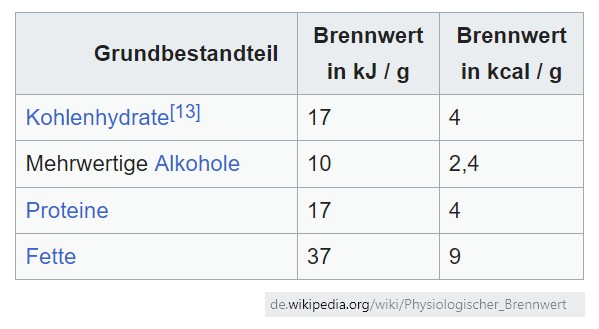
Nüsse besitzen demnach einen Brennwert von 2000 – 2600 kJ/100 g bzw. 20 – 26 kJ/g. Sie bestehen aus ca. 60% Fett, 25% Protein und 10% Kohlenhydraten. Der Brennwert von reinem Fett liegt noch um einiges höher bei 37 kJ/g.
Die ersten Sachen für das Experiment habe ich mittlerweile besorgt:

Die Getränkedose mit 330 ml Inhalt soll die innere Dose werden, in die das Wasser kommt:

Als Lebensmittel habe ich mich für Walnüsse entschieden:



Im Hausmüll erblickte mein Auge eine genau passende, äußere Aludose, welche ich mir gleich aus der Tonne fischte. Dies ist doch wahres Recycling oder?

Die Lüftungslöcher am Boden:

Die kleine Getränkedose erhielt auch eine Bohrung für die Filzstifthalterung:

Die beiden Dosendurchmesser scheinen perfekt zu passen:


Zuerst nahm ich eine Messung nur mit der Getränkedose vor:


Die Aludose wiegt 7.70 g:


Die Masse des Wassers beträgt 54.49 g…

…und jene der Nuss vor der Verbrennung 8.77 g:

Starttemperatur des Wassers war 13.5 °C:

Hier erkennt man sehr gut die brennende Nuss:


Den Versuch brach ich bei einer Wassertemperatur von 41.8 °C ab:

Die Getränkedose war stark verrußt (Ruß = unvollständig verbrannter Kohlenstoff), was natürlich schlecht ist für die Bestimmung des Brennwerts. Ich rechne daher mit einem deutlich zu niedrigen Wert…

Masse der Nuss nach der Verbrennung = 8.22 g:

Die nicht allzu komplexe Berechnung des Brennwerts:

Die prozentuelle Abweichung vom Sollwert für Walnüsse ist sehr hoch, aber ich habe damit gerechnet. Mal schauen ob der zweite Aufbau mit 2 Dosen ein (deutlich) besseres Resultat liefert.


Die Nüsse trocknete ich vorher in meinem Backofen, wobei ich die Temperatur mit rund 125 °C zu hoch wählte. Besser wären 105 °C gewesen…


Dadurch waren die Nüsse nach dem Trocknen schon sehr dunkel:

Zur besseren Durchlüftung bohrte ich noch zusätzliche Löcher in die äußere Dose:

Masse der äußeren Dose = 42.39 g:


Wassermasse = 54.96 g:

Walnussmasse vor dem Verbrennen = 8.70 g:

Wassertempertur zu Beginn = 15.1 °C:



Am Ende der Messung war das Wasser beachtliche 50.1 °C heiß:

Die verkohlte Walnuss:

Deren Masse betrug nun 8.22 g:


Es gab aber leider nach wie vor sehr starke Rußbildung. Man müsste eigentlich der brennenden Nuss Sauerstoff zuführen. Es gibt Sauerstoffkonzentrator zu kaufen, welche aber ein paar hundert Euro kosten und damit für dieses Schulexperiment nicht in Frage kommen. Denn es gilt wie immer, so einfach und günstig wie möglich.

Die äußere Dose erhitzte sich während des Experiments auf rund 35 °C:

Hier nun die Rechnung für das 2-Dosen-Kalorimeter:

Na, das schaut ja gar nicht mal so schlecht aus. Ich erhalte einen Brennwert für die Walnuss von 17.49 kJ/g bei einem Sollwert von 28.2 kJ/g. Damit beträgt die Abweichung „nur“ mehr 38%. Damit kann ich aber absolut leben, denn ich ging eigentlich im Vorfeld von geschätzten 50% aus. Von daher wurde ich sogar ein wenig positiv überrascht…
Reine Fette besitzen laut obiger Tabelle einen Brennwert von 37 kJ/g, Kohlenhydrate hingegen „nur“ 17 kJ/g. Die Nuss bestand ja überwiegend aus Fett. Nun wollte ich mit meinem 2-Dosen-Kalorimeter noch einen niedrigeren Wert für ein kohlehydrat/zucker-reiches Lebensmittel nachweisen. Mir war von vornherein klar, dass dies ein schwieriges Unterfangen sein wird, denn Kohlenhydrate brennen alles andere als gut. Aber ich wollte es zumindest versucht haben. 😉
Hier die Liste der Misserfolge:
- Gummibären


- Zuckerwürfel mit Docht und ein wenig Spiritus



- Hörnchen aus Hartweizengrieß


- getoastetes Toastbrot


- Kellogg’s Toppas

Schön schwarz wieder aber eigentlich keinerlei Flamme

- Zuguterletzt probierte ich Maisstangen, da diese sehr grobporig sind und demnach mehr Sauerstoff zur Flamme kommen könnte.

Nach dem Anzünden war zwar eine kleine Flamme sichtbar, aber nachdem sie die ganze Oberseite abgewandert ist, erlosch sie wieder. Durch diese sehr instabile und kleine Flamme, welche zudem nach kurzer Zeit wieder ausgeht, ist eine Verwendung in meinem 2-Dosen-Kalorimeter eigentlich völlig ausgeschlossen. Schade…

Also bleiben die Messungen mit fettreichen Lebensmitteln.
Fazit: Ich finde der Versuch eignet sich sehr gut fürs Schullabor, da die Schüler das Kalorimeter erstens leicht selbst basteln und dann bedienen können und zweitens erhalten sie einen schönen Einblick in die Bestimmung des Brennwerts von Lebensmitteln, der ja auf jeder Verpackung abgedruckt ist. Vielleicht erstaunt es auch den einen oder anderen Schüler, dass zum Beispiel Nüsse bestens brennen und Kohlehydrate nahezu gar nicht. Von daher Daumen rauf, denn selbst experimentiert ist 1000-mal lehrreicher und nachhaltiger als bloße Theorie.

