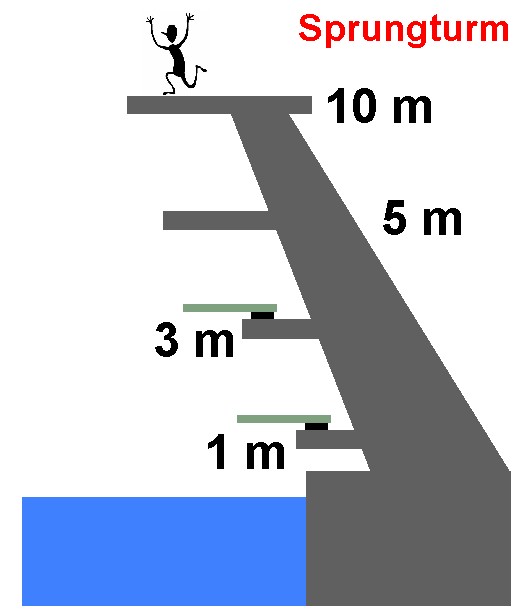
Die energetischen Elektronenzustände im Atom sind ja gequantelt, das heißt es kommen nur ganz bestimmte, diskrete Energien vor (zumindest bei einzelnen Atomen). Dies vergleiche ich immer mit einem Sprungturm im Schwimmbad. Dort gibt es auch nur ein 1 m- und 3 m-Brett und dann die 5 m-, 7 m und 10 m-Plattform. Ein 2.3 m Brett kommt nicht vor.
Im sog. Termschema sind diese einzelnen Quantenzustände des Atoms, Moleküls oder Festkörpers energetisch aufgezeichnet. Um von einem „unteren“ Zustand in einen „oberen“ Zustand zu gelangen, benötigt das Elektron Energie zum Beispiel im Form einen Lichtteilchens/Photons. Dieses besitzt ja die Energie E = h · f (h … Plancksche Wirkungsquantum, f … Frequenz des Photons). Wird das einfallende Lichtteilchen für den Sprung nach oben verwendet, so spricht man von Absorption. Hier gibt es aber aufgrund der gequantelten Zustände etwas zu beachten.
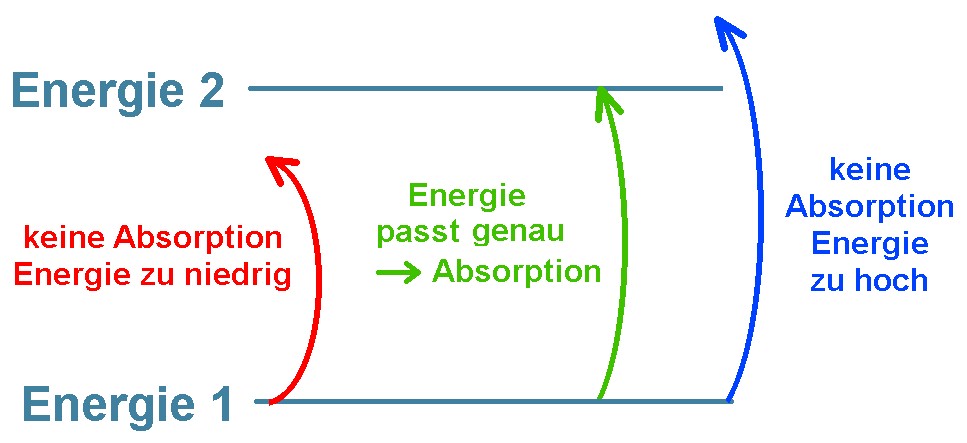
Die Energie des absorbierten Photons muss genau für den Sprung passen. Sie darf weder zu gering, noch zu hoch sein. Im oberen Bild wird also nur grünes Licht verschluckt und dient zur Anregung des Elektrons.
Das angeregte Elektron verbleibt aber in der Regel nur extrem kurz im angeregten Zustand und fällt gleich wieder in den Grundzustand. Dabei sendet es Licht mit einer Frequenz f entsprechend dem Energieunterschied ΔE des angeregten Zustands zum Grundzustand. Es gilt dabei wieder: f = ΔE / h. Sind die beiden Sprünge nach oben bzw. unten ident, so sind die Farben des absorbierten und des emittierten Lichtteilchens ident! Im obigen Fall wird also wieder ein grünes Licht emittiert.

Denken wir weiter. Wenn die Energien genau stimmen müssen, dann hat wohl ein bestimmtes Atom (z.B. Natrium) genau das von demselben Atom emittierte Licht am liebsten. Denn dann passen die Energien genau. Bringt man also Natrium z.B. mittels einer Natriumdampflampe zum Leuchten und bestrahlt damit Natriumgas, so werden sehr viele Photonen absorbiert. Stimmt die Lichtfrequenz also genau für den Absorber, so spricht man von Resonanzabsorption.

Dazu gibt es ein schönes Experiment mit einem verblüffenden Ergebnis. Man bestrahlt mit einer Natriumdampflampe eine Wand. Diese erstrahlt in einem Orange. Denn das in der Lampe angeregte Natrium sendet primär Licht bei den Wellenlämgen 589.0 nm und 589.6 nm aus. Dies ist die bekannte Natrium Doppel-D-Linie:
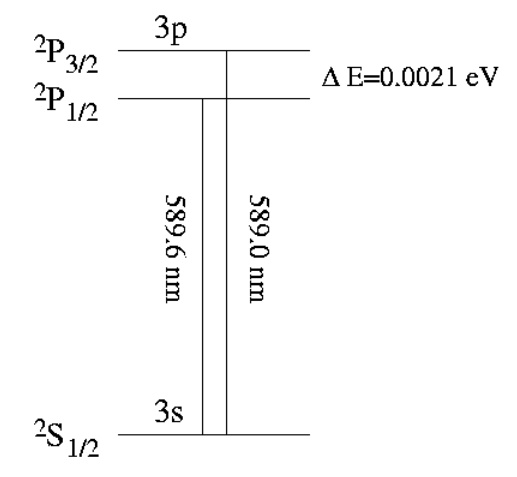
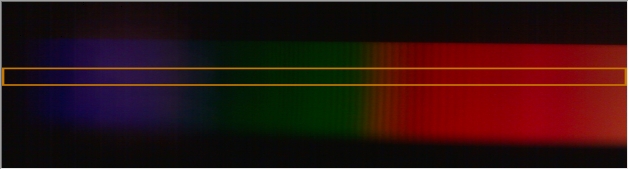
Mit einem sehr guten Spektroskop lassen sich diese beide Emissionslinien sogar trennen. Hier ein mit meinem DSLR-Spektroskop gemachtes Foto:

Zündet man nun eine Gasbrenner zwischen Natriumdampflampe und Wand an, so erscheint die Flamme an der Wand nahezu undurchsichtig. Denn die orangen Photonen können die Gasflamme ungehindert durchdringen. Jetzt kommt aber das Besondere.

Hält man einen mit Kochsalz (Natriumchlorid) bestreuten Magnesiastab in die Flamme, so färbt sich die Flamme durch die darin enthaltenen angeregten Natriumatome auch orange. Die Energie der Photonen aus der Natriumlampe passt aber nun perfekt für die Natriumatome in der Flamme und sie werden absorbiert. Gleich darauf kommt es wieder zur Emission aber nun in alle Richtungen gleichermaßen. Die Folge ist, dass die ursprünglich auf dem Weg durch die Flamme zur Wand unterwegs seienden Photonen zum Großteil „abgelenkt“ werden und nicht mehr die Wand erreichen. Infolgedessen erscheint die Flamme auf der Wand dunkel!
Meine Natrium-Niederdruckdampflampe:



Der gesamte Aufbau:



Ohne Kochsalz in der Flamme wirft diese keinen Schatten im Licht der Natriumdampflampe:



Gibt man nun allerdings Natrium in die Flamme so kommt es zur Resonanzabsorption und die Flamme wirft einen Schatten, voila…


Jetzt könnte aber jemand behaupten, dass dafür die Flamme selbst die Wand in oranges Licht färbt und alles aufhellt. Das tut sie auch aber eben die ganze Wand ziemlich gleichmäßig. Der dunkle Schatten der Flamme wird dadurch zwar etwas heller aber dieser Zugewinn ist in der Regel deutlich geringer als der Verlust durch die Resonanzabsorption.
Diese Resonanzabsorption möchte ich aber noch durch zwei weitere Experimente nachweisen. Dazu benötigt man ein Spektroskop, eine starke Weißlichtquelle (z.B. 50W LED oder Halogenlampe) und wieder einen Brenner inkl. Magnesiastäbchen und Kochsalz. Hier der Aufbau:
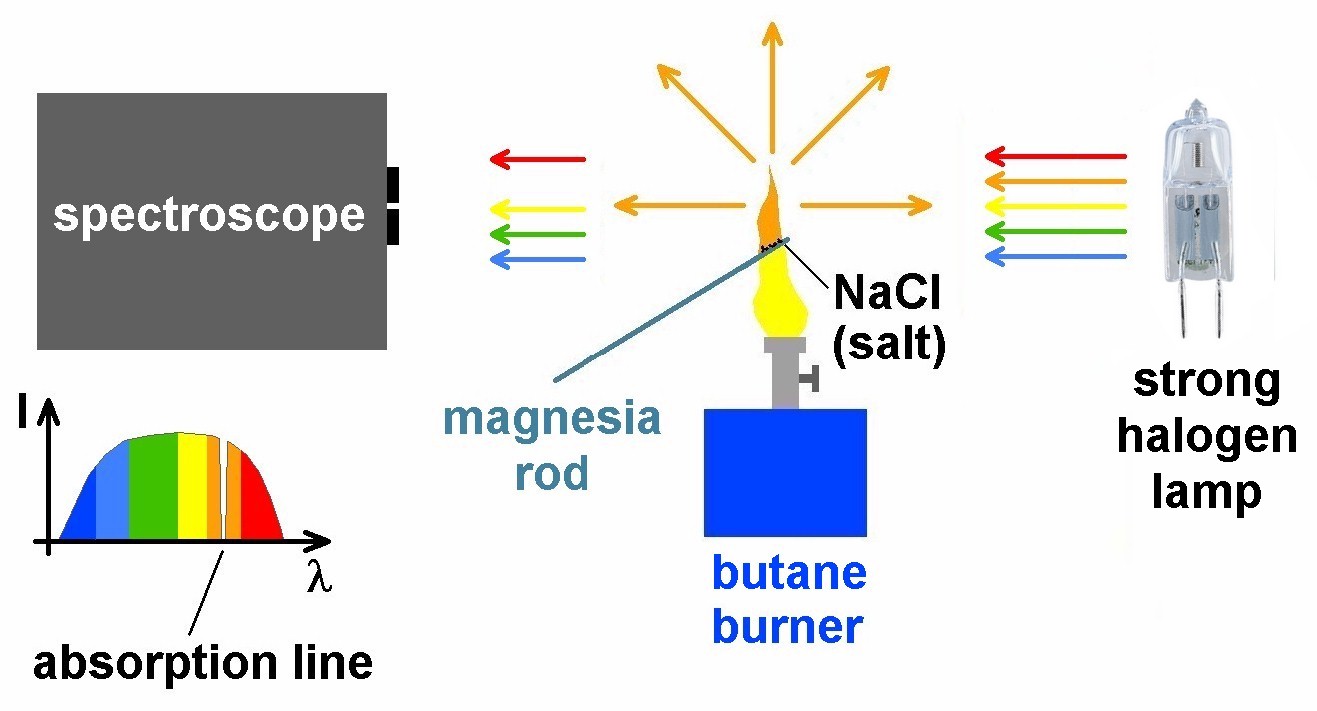
In der orangen Natriumflamme kommt es wieder zur Resonanzabsorption. Dieses mal verwenden wir aber eine weiße Lichtquelle mit einem kontinuierlichen Emissionsspektrum. Das Natrium in der Flamme pickt sich also nur die orangen Photonen heraus. Diese werden zwar wieder sogleich emittiert, aber eben in alle Richtungen. Daher fehlen im am Spektroskop auftreffenden Licht genau die beiden orangen Wellenlängen, konkret 589.0 und 589.6 nm. Im mit dem Spektroskop erhaltenen Spektrum erhält man an diesen beiden Stellen bzw. aufgrund geringerer Auflösung nur an einer Stelle eine dunkle Absorptionslinie. Soweit die Theorie.
Als Natriumquelle dient gewöhnliches Kochsalz:

Hier sieht man die 50W Halogenlampe, den Butanbrenner und das mit NaCl benetzte Magnesiastäbchen vor dem Eingang meines Webcam-Spektroskops:



Das erhaltene Spektrum nur mit der Natriumflamme:

Die schöne Emissionslinie bei rund 589 nm (Anm.: Eine Auflösung der Doppellinie ist mit diesem Spektroskop nicht möglich!):

Das kontinuierliche Spektrum nur mit eingeschalteter Halogenlampe:


Zum Schluss das Spektrum mit Halogenlampe + Natriumflamme:

Wie man anhand der nachfolgenden Abbildung sehen kann, erhalte ich leider nicht wie zu erwarten war eine dunkle Absorptionslinie bei 589 nm, sondern eine helle Emissionslinie.

Was läuft hier schief?
Nun, wie oben schon gesagt, absorbiert die orange Natriumflamme zwar durch Resonanz orange Photonen, aber die Flamme selbst ist natürlich auch eine Lichtquelle und zwar ebenfalls mit genau dieser orangen Wellenlänge. Und in diesem Fall überwiegt die Emission der Natriumflamme verglichen mit deren Absorption.
Ich habe bisher schon einiges unternommen, um doch die erwünschte dunkle Absorptionslinie zu erhalten. So vergrößerte ich den Abstand der LED und der Flamme zum Spektroskop, damit die Intensität des störenden Flammenlichts am Ort des Spektroskops geringer wird. Dies brachte allerdings keinen Erfolg. Die Emissionslinie wurde dadurch zwar geringer, aber eine dunkle Linie war weit und breit nicht zu erkennen. Dann variierte ich auch die Position des Magnesiastabs mit dem Kochsalz in der heißen Butanbrennerflamme. Denn es gilt folgendes: Für die Adsorption von Licht müssen sich die Elektronen weitestgehend im Grundzustand befinden. In der sehr heißen, womöglich zu heißen Flamme befinden sich viele der Elektronen im angeregten Zustand. Sie können dann zwar durch das nachfolgende „Herunterfallen“ oranges Licht emittieren aber in diesem Zustand kein oranges Licht absorbieren. Aber genau das möchte ich ja. Daher habe ich mir auf Amazon zwei Alkoholbrenner bestellt in der Hoffnung, dass deren Flamme weniger heiß ist und sich somit mehr Elektronen im Grundzustand befinden und dadurch besser absorbieren.



Eine starke, fokussierbare weiße LED-Taschenlampe habe ich auch gleich mitbestellt:


Breiter Lichkegel:

Schmaler Lichtkegel, perfekt für mein Experiment:

Das zweite Setup:

Für den Alkoholbrenner verwende ich Spiritus:


Mein Aufbau im Wohnzimmer, welches man aufgrund meiner vielen Experimente wohl nicht mehr so richtig bewohnen kann 😉


Zuerst nur mit Taschenlampe und Flamme noch ohne Natrium:


Ein schönes kontinuierliches Spektrum ohne Absorptionslinien:


Jetzt mit Kochsalz in der Flamme, also mit der Natriumflamme:



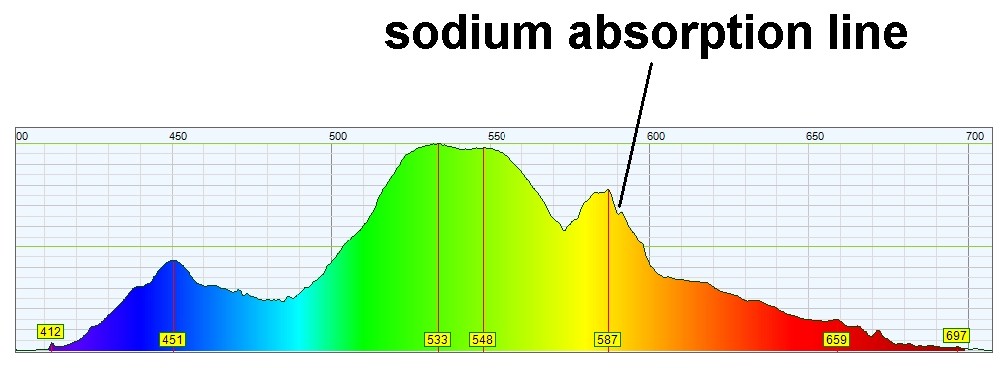
Zu meiner Freude erkennt man nun tatsächlich eine schwache Absorptionslinie bei 589 nm, Heureka…



Ich habe mir noch Methanol und Natriumnitrat (NaNO3) besorgt. Das Methanol sollte verglichen mit dem Spiritus ohne Natrium eine weniger gelbe Flamme erzeugen. Und das Natriumnitrat teste ich als Ersatz für das Kochsalz (NaCl). Wenn es Neuigkeiten gibt, geht es hier weiter. Aber erstmals bin ich mit den Ergebnissen zufrieden 😉
Das dritte Experiment entspricht genau dem zweiten mit dem Unterschied, dass ich nun die Resonanzabsorption von Iod anstelle von Natrium nachweisen möchte. Auf aliexpress gibt es eine mit Iod gefülltes Glasgefäß sehr günstig zu kaufen:


Erhitzt man das Gefäß mit einer Flamme, so geht das Iod in den gasförmigen Zustand (Siedetemperatur bei Normaldruck lediglich 184.3 °C) über. Das Gas ist auffallend pink gefärbt:

Ganz oben habe ich das simple Termschema von Natrium abgebildet. Jenes von molekularem Jod ist weitaus komplexer. Unter anderem deshalb, weil die beiden Atome des Iodmoleküls rotieren und schwingen können. Diese Energien liefern zusätzlich unzählige Stufen im Termschema:

Das Absorptionsspektrum von Jod müsste also dadurch ungleich komplexer aussehen als die beiden Natrium-Linien. Dies möchte ich zeigen…
Das mit gasförmigen Jod gefüllte Glasgefäß zwischen Weißlichtquelle (50W Halogenlampe) und dem Eintrittsspalt des Spektroskops:


Das Spektrum der Halogenlampe noch ohne Jodgas:



Und nun mit Jodgas:

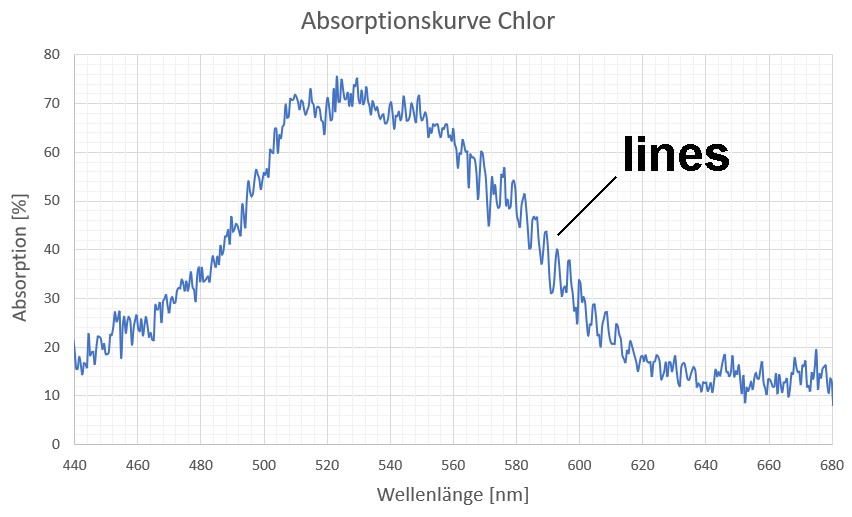
Man erkennt in der Tat sehr viele dunkle Absorptionslinien, Heureka 😉
Mittels beider Intensitätsverläufe (nur Halogen bzw. Halogen + Jod) lässt sich das Absorptionsspektrum von Jod ermitteln, wobei gilt: Absorptionsgrad = 100% – (Imit Jod / Iohne Jod) · 100. Der mit Excel erstellte Graph sieht dann wiefolgt aus: