Osmose spielt in zahlreichen Fällen eine entscheidende Rolle, etwa bei der Urinbildung in den Nieren. In den Nieren sorgt Osmose dafür, dass Wasser aus dem Blutplasma in das Nierenmark zurückgewonnen wird und hilft so, den Wasserhaushalt im Körper zu regulieren. Oder etwa bei den Pflanzen, um ihren Wassergehalt trotz des ständigen Wasserverlusts durch Transpiration aufrecht zu erhalten.
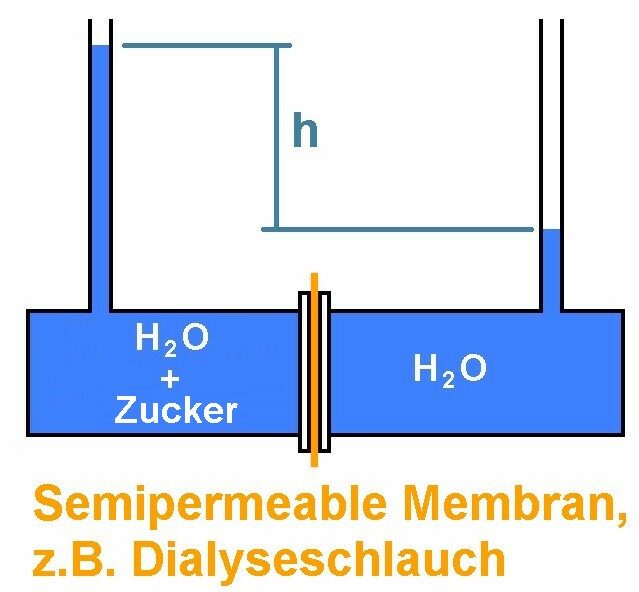
Nehmen wir ein Gefäß mit zwei Kammern her, die durch eine sog. semipermeable Membran getrennt sind. In einer Kammer befindet sich zum Beispiel reines Wasser, in der anderen eine Zuckerlösung. Die semipermeable Membran ist für Wassermoleküle durchlässig aber nicht für den gelösten Stoff (die Zuckermoleküle).
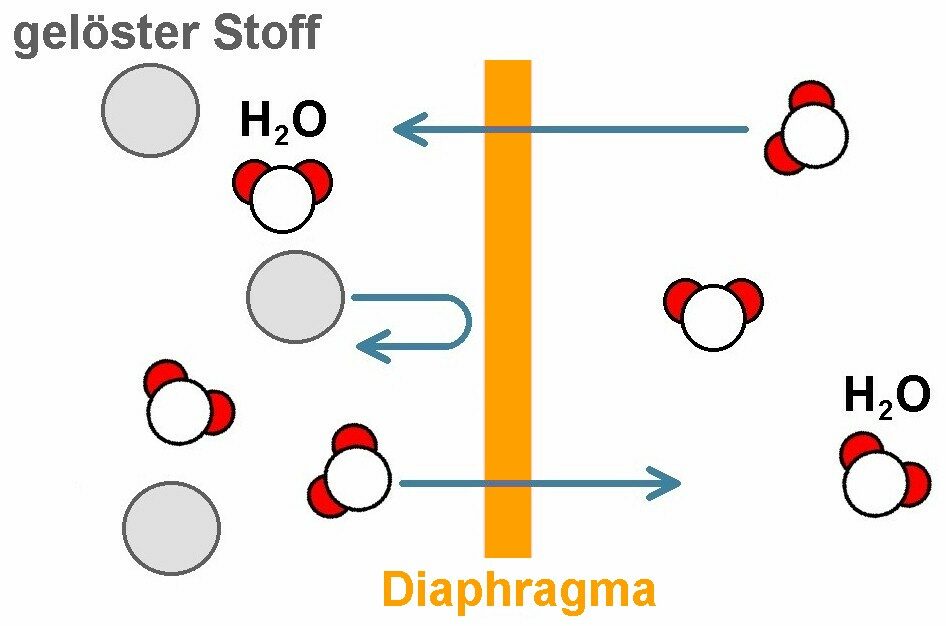
Was wird passieren. Es werden insgesamt mehr Wassermoleküle konkret von rechts nach links die Membran passieren als von links nach rechts. Dadurch steigt der Spiegel im linken Glasrohr an und im rechten sinkt er. Der Druckunterschied Δp = ρ · g · h hängt von der Menge des links gelösten Stoffs ab. Je stärker also die Zuckerlösung, desto höher steigt der Wasserspiegel im linken Rohr und desto höher ist der sog. osmotische Druck Π = Δp. Für diesen gilt:

Der osmotische Druck lässt sich also mit dem Gasgesetz p·V = ν·R·T bestimmen, wobei für die Molmenge ν jene des gelösten Stoffs (hier der Zucker) einzutragen ist.
Der Unterschied h der beiden Wasserspiegel müsste demnach direkt proportional zur Menge an hinzugefügtem Zucker sein. Dies möchte ich experimentell überprüfen.
Für das Experiment benötigt man also neben Wasser und Zucker auch noch die semipermeable Membran. Als solche eignet sich etwa ein Dialyseschlauch, welchen man für wenig Geld z.B. auf Aliexpress erhält:




Für mein Osmometer habe ich mich für folgenden Aufbau entschieden:
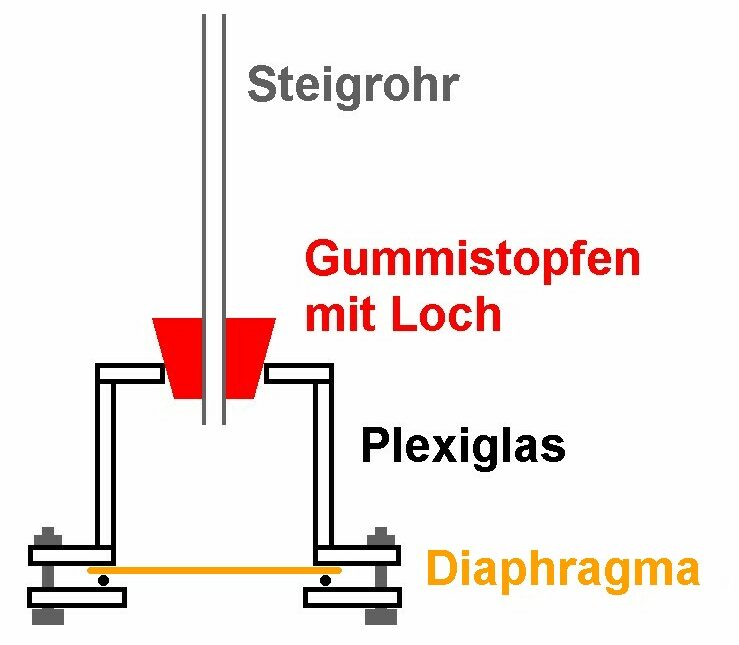
Hier einige Bilder der Entstehung:








Die nicht vorhandenen Teile wie Plexiglaskleber, große Dichtringe und Plexiglasrohr habe ich auf Amazon bestellt:


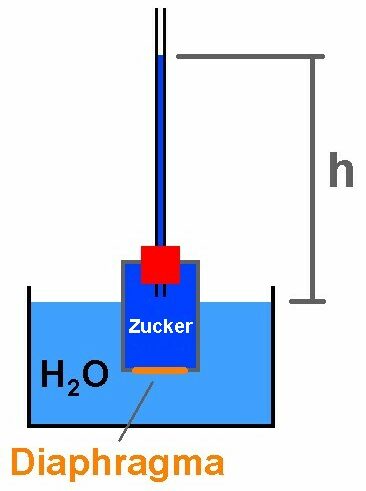
Der gesamte Aufbau wird dann so aussehen, wobei ich die Steighöhe h in Abhängigkeit von der Zuckermenge mZucker bestimme:
Die Amazon-Lieferung ist wie gewohnt extrem schnell angekommen:

Die 35 cm langen Plexiglasröhren mit OD 6 mm und ID 4 mm:


Der Kunststoffkleber…

…welchen ich auch gleich zum Kleben der Osmosekammer verwendet habe:


Die einzelnen Schritte bis zum fertigen Osmometer:









Als gelösten Stoff verwende ich gewöhnlichen Würfelzucker (Saccharose):


Für die erste Messreihe habe ich 2 Stück Würfelzucker (je ca. 3.5 g) aufgelöst und dann in die Kammer (ca. 75 ml Fassungsvermögen) geschüttet.


Um abschätzen zu können, wie hoch das Zuckerwasser im Rohr steigen wird, habe ich folgende Rechnung angestellt: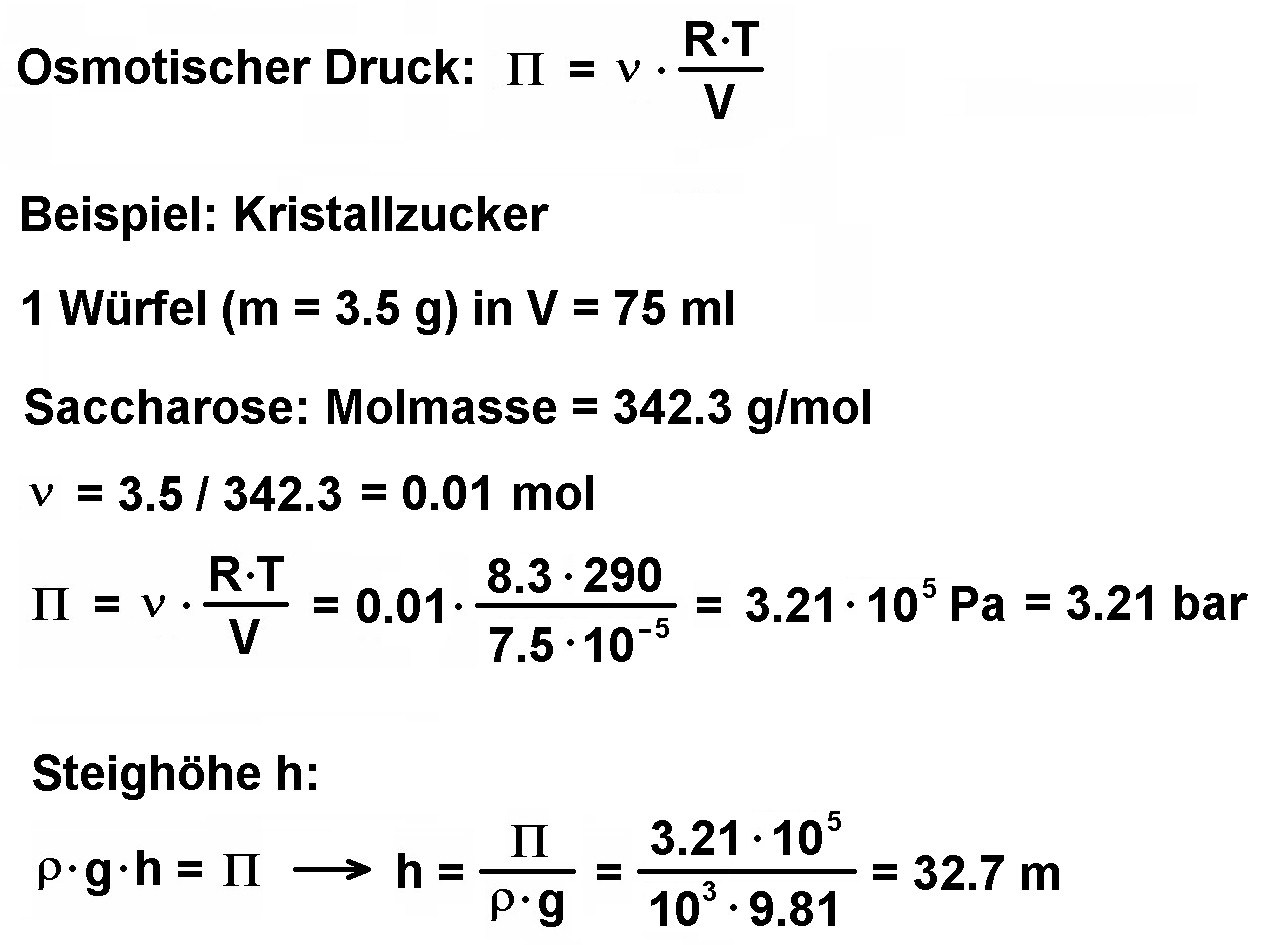
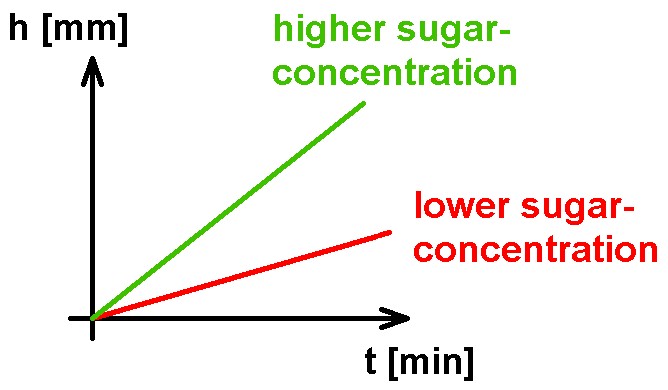
Demnach kann ich bereits bei nur einem Stück Würfelzucker mit einer Steighöhe von ca. 33 m rechnen. Mit dem habe ich natürlich nicht gerechnet 😉 Also fällt mein ursprünglicher Plan, die Steighöhe h in Abhängigkeit von der Zuckermenge zu bestimmen, ins Wasser. Stattdessen werde ich die Geschwindigkeit des Anstiegs im Rohr dokumentieren. Dieser müsste eigentlich auch von der Zuckerkonzentration abhängen. Je höher diese ist, desto größer ist der osmotische Druck und desto schneller müsste das Zuckerwasser im Rohr ansteigen.
Zunächst einmal die Ergebnisse für 2 Stück gelöste Würfelzucker. Den Startpunkt des Flüssigkeitsspiegels in der Röhre markierte ich mit einem Stift:








Nach 12 Stunden kontrollierte ich mein Osmometer. Die Zuckerlösung war inzwischen das ganze Rohr hochgestiegen und rannte oben heraus. Kein Wunder bei einer hypothetischen Steighöhe von rund 65 m…


Danach wiederholte ich den Versuch mit 4 Stück Würfelzucker in der Kammer und nahm abermals die wachsende Steighöhe h in Abhängigkeit von der Zeit t auf.

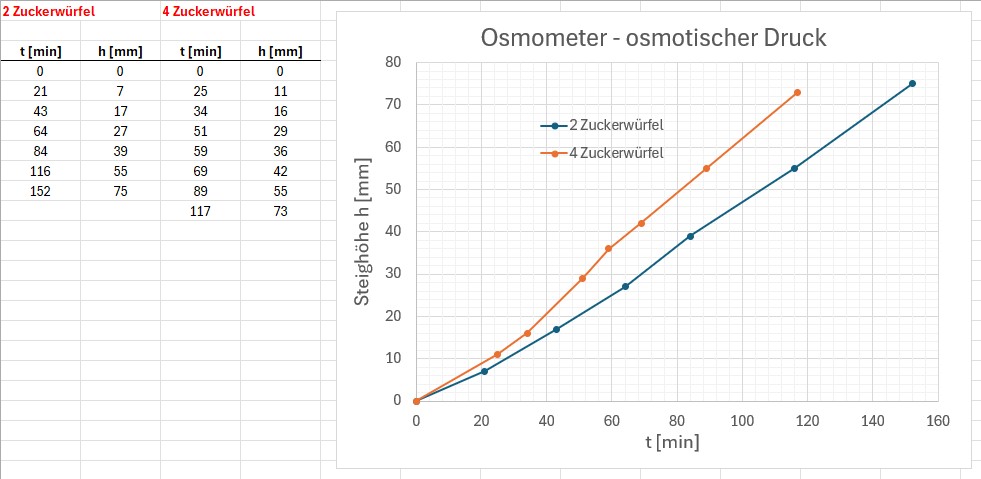
Zum Schluss die Messergebnisse und die beiden Graphen h(t) für 2 bzw. 4 Stück Würfelzucker. Bei einer höheren Zuckerkonzentration stieg die Lösung wie zu erwarten war schneller an, Heureka 😉
Eine doppelt so hohe Steiggeschwindigkeit bei doppelter Konzentration konnte ich aber indes nicht messen.
Das Youtube-Video reiche ich noch nach…

